Відділ механізмів біоорганічних реакцій (до 2001 р. – відділ хімії фотосинтезу) створено в 1963 році на основі групи біокаталізу відділу механізмів органічних реакцій Інституту органічної хімії АН України. Багато років відділом керував чл.-кор. НАН України, доктор хімічних наук, професор О.О. Ясников. З 1999 р. відділ очолює доктор хімічних наук, професор А.І. Вовк (чл.-кор. НАН України з 2009 р.). У відділі проводяться фундаментальні наукові дослідження в області біоорганічної хімії, спрямовані на з’ясування механізмів біоорганічних перетворень, синтез і вивчення властивостей нових біоактивних сполук та встановлення зв’язку між їх структурою і активністю.
Основні напрями наукової діяльності відділу включають вивчення механізмів модельних реакцій та механізмів біоактивності природних і синтетичних органічних сполук, конструювання і синтез потенційно біоактивних органічних молекул, встановлення взаємозв’язку між їх структурою і активністю, а також прогнозування біоактивності методами комп’ютерного моделювання. Об’єктами досліджень є природні і синтетичні гетероциклічні та фосфороорганічні сполуки, а також терапевтично важливі гідролази, трансферази, оксидоредуктази та інші протеїнові структури як потенційні мішені. Тематика робіт, що виконуються останнім часом, присвячена дослідженню властивостей біоактивних структурних аналогів вітаміну В1, пошуку, конструюванню, синтезу і вивченню інгібіторів неспецифічних лужних фосфатаз, протеїнтирозинфосфатаз, холінестераз, глутатіон-S-трансфераз, ксантиноксидази, α-глюкозидази та інших ензимів. Продовжується вивчення антиоксидантів і спінових зондів. Поряд з експериментальними підходами in vitro, в дослідженнях використовуються методи молекулярного докінгу, молекулярної динаміки і QSAR.
К.х.н., с. д. Кобзар Олександр Леонідович
https://www.scopus.com/authid/detail.uri?authorId=57205476268
https://orcid.org/0000-0003-4370-7041
https://scholar.google.com.ua/citations?user=cmcLKhAAAAAJ&hl=uk
https://nauka.gov.ua/researchers/rs.3WmphPcT/
К.х.н., с.н.с. Танчук Всеволод Юлійович
https://orcid.org/0000-0001-9055-870X
https://www.scopus.com/authid/detail.uri?authorId=6701780283
https://scholar.google.com/citations?user=W5UXRO0AAAAJ&hl=uk&oi=sra
К.х.н., н.с. Музичка Оксана Володимирівна
https://www.scopus.com/authid/detail.uri?authorId=6506102477
https://scholar.google.com/citations?hl=uk&user=cQsR9vMAAAAJ
https://orcid.org/0000-0001-9856-7221
К.х.н., н.с. Булденко Владислав Миколайович
https://www.scopus.com/authid/detail.uri?authorId=57205554823
https://orcid.org/0000-0003-2999-9826,
https://scholar.google.com/citations?user=0ePOahkAAAAJ
К.х.н., н.с. Суховєєв Олександр Володимирович
https://www.scopus.com/authid/detail.uri?authorId=57074049200
https://orcid.org/0000-0001-9949-2188
https://scholar.google.com.ua/citations?user=cabJcfsAAAAJ&hl=uk
Д.ф., м.н.с. Шульга Юрій Васильович
https://www.scopus.com/authid/detail.uri?authorId=57511352600
https://orcid.org/0000-0002-1073-0600
https://scholar.google.com/citations?user=4OXTXUMAAAAJ&hl=uk
Д.ф., м.н.с. Бейко Альона Віталіївна
https://www.scopus.com/authid/detail.uri?authorId=58400439000
https://orcid.org/0000-0003-1119-988X
https://scholar.google.com.ua/citations?user=4LN3jWQAAAAJ&hl=uk
Публікації співробітників відділу (з 2020 року)
1. Myshko, A. S., Mrug, G. P., Bondarenko, S. P., Demydchuk, B. A., Kobzar, O. L., Buldenko, V. M., Vovk A.I., Frasinyuk, M. S. (2025). Divergent synthesis of novel 3 (5)‐aminoazole–benzopyrone hybrids and their evaluation as α‐glucosidase Inhibitors. ChemMedChem, 20(5), e202400525. https://doi.org/10.1002/cmdc.202400525

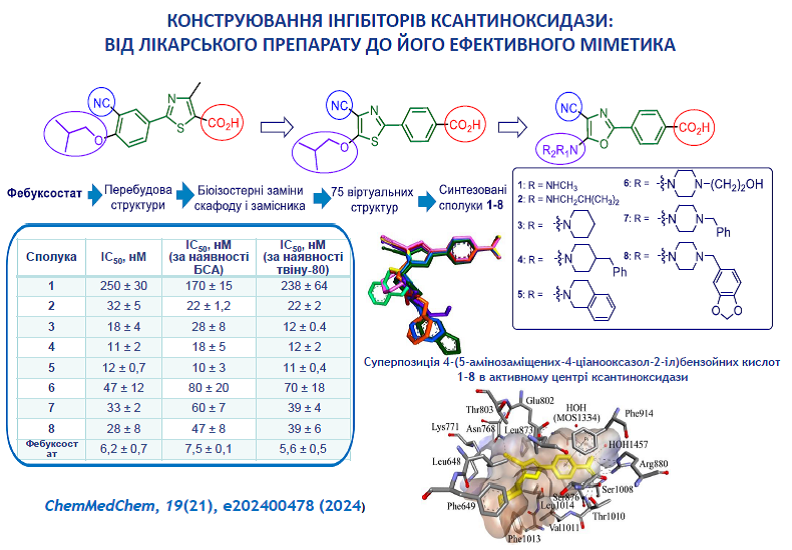
2. Kobzar, O., Beiko, A., Merzhyievskyi, D., Shablykin, O., Brovarets, V., Tanchuk, V., Vovk, A. Design, synthesis, and xanthine oxidase inhibitory activity of 4‐(5‐aminosubstituted‐4‐cyanooxazol‐2‐yl) benzoic acids. ChemMedChem 2024, 19(21), e202400478. https://doi.org/10.1002/cmdc.202400478

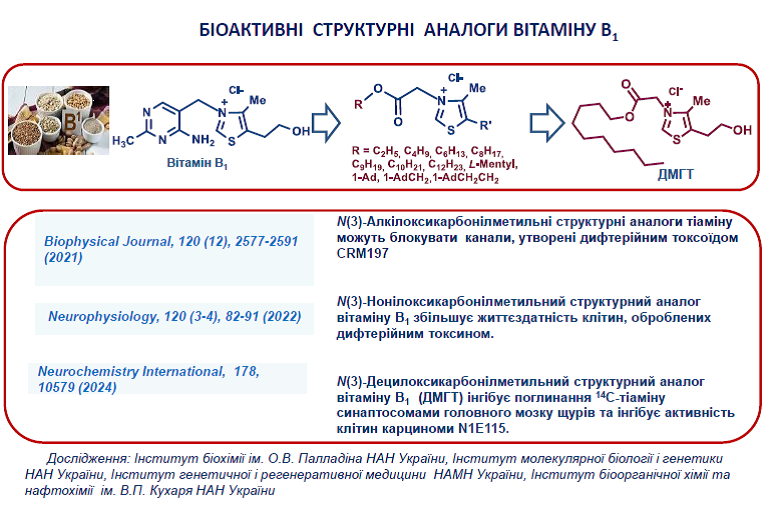
3. Parkhomenko, Y. M., Vovk, A. I., Protasova, Z. S., Pylypchuk, S. Y., Chorny, S. A., Pavlova, O. S., Pylypchuk, Yu., Stepanenko, S. P. Thiazolium salt mimics the non-coenzyme effects of vitamin B1 in rat synaptosomes. Neurochemistry International 2024, 178, 105791. https://doi.org/10.1016/j.neuint.2024.105791
4. Myshko, A. S., Mrug, G. P., Bondarenko, S. P., Kondratyuk, K. M., Kobzar, O. L., Buldenko, V. M., Vovk, A.I., Frasinyuk, M. S. Trapping of thermally generated ortho-and para-quinone methides by imidazoles and pyrazoles: a simple route to green synthesis of benzopyrone-azole hybrids and their evaluation as α-glucosidase inhibitors. RSC advances 2024, 14(38), 27809-27815. https://doi.org/10.1039/D4RA05230G
5. Zhirnov, V., Shablykin, O., Chumachenko, S., Kornii, Y., Keith, K. A., Harden, E. A., Hartline, C.B., James, S.H., Kobzar, O., Kovalishyn, V., Vovk, A., Brovarets, V. In vitro activity of novel 4-iminohydantoin sulfamide derivatives against human cytomegalovirus. Chemical Papers. 2024, 1, 133-140. https://doi.org/10.1007/s11696-023-03038-1
6. Kovalishyn, V., Severin, O., Kachaeva, M., Kobzar, O., Keith, K. A., Harden, E. A., Caroll, H., James, S.H., Vovk, A., Brovarets, V. In silico design and experimental validation of novel oxazole derivatives against varicella zoster virus. Mol. Biotechnol. 2024, 66(4), 707-717. https://doi.org/10.1007/s12033-023-00670-w2020
7. Demchenko, S., Yarmoluk, S., Sukhovieiev, V., Golovchenko, O., Sukhovieiev, O., Demchenko, A. Syntheses and evaluation of novel 3-hydroxy-1,3-diaryl-2,3,5,6,7,8 hexahydroimidazo[1,2a]pyridine-1-ium bromides as potential anticancer agents. Pharmacia 2024, 71, 1-10. https://doi.org/3897/pharmacia.71.e135992
8. Tanchuk, V.Y., Kobzar, O.L., Vovk, A.I. Classification of active site conformations of protein tyrosine phosphatase 1B revisited. Bioorg. Acta 2024, 19(1), 54-60.
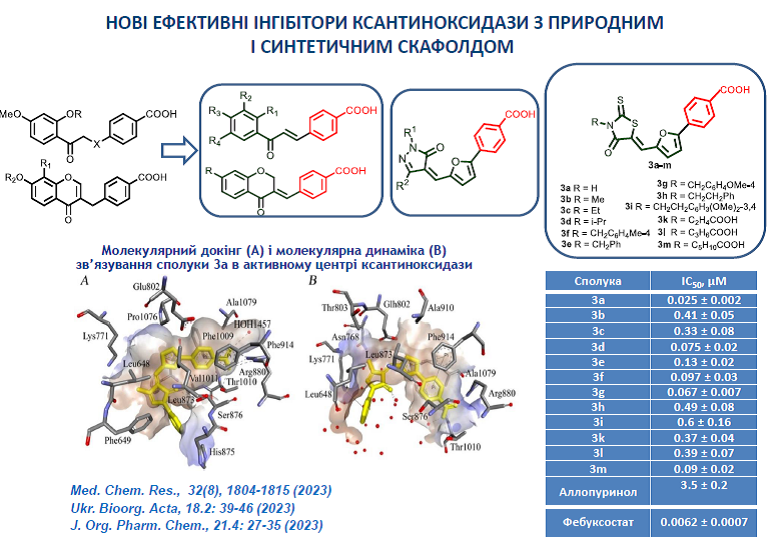
9. Beiko, A.V.; Kobzar, O.L.; Kachaeva, M.V.; Pilyo, S.G.; Tanchuk, V.Y.; Vovk, A.I. Inhibition of xanthine oxidase by pyrazolone derivatives bearing a 4-(furan-2-yl)benzoic acid moiety. J. Org. Pharm. Chem. 2023, 21, 27-35. https://doi.org/10.24959/ophcj.23.298726.
10 Beiko, A.V.; Kobzar, O.L.; Kachaeva, M.V.; Pilyo, S.G.; Kozachenko, O.P.; Vovk, A.I. Rhodanine-based 4-(furan-2-yl)benzoic acids as inhibitors of xanthine oxidase. Ukr. Bioorg. Acta 2023, 18(2), 31-40. https://doi.org/15407/bioorganica2023.02.031.
11. Los, O. V., Sinenko, V. O., Kobzar, O. L., Zhirnov, V. V., Vovk, A. I., Brovarets, V. S. Synthesis and in vitro anticancer potential of new thiazole-containing derivatives of rhodanine. Heterocycl. Compd. 2023, 59(6-7), 484-493. https://doi.org/10.1007/s10593-023-03220-z

12. Velihina, Y., Gesese, R., Zhirnov, V., Kobzar, O., Bui, B., Pilyo, S., Vovk, A., Shen, H., Brovarets, V. Design, synthesis and evaluation of the anti-breast cancer activity of 1, 3-oxazolo [4, 5-d] pyrimidine and 1, 3-oxazolo [5, 4-d] pyrimidine derivatives. RSC Med. Chem. 2023, 14(4), 692-699. https://doi.org/10.1039/D2MD00377E
13. Kobzar, O. L., Tatarchuk, A. V., Mrug, G. P., Bondarenko, S. P., Demydchuk, B. A., Frasinyuk, M. S., Vovk, A. I. Carboxylated chalcones and related flavonoids as inhibitors of xanthine oxidase. Chem. Res. 2023, 32(8), 1804-1815. https://doi.org/10.1007/s00044-023-03109-8
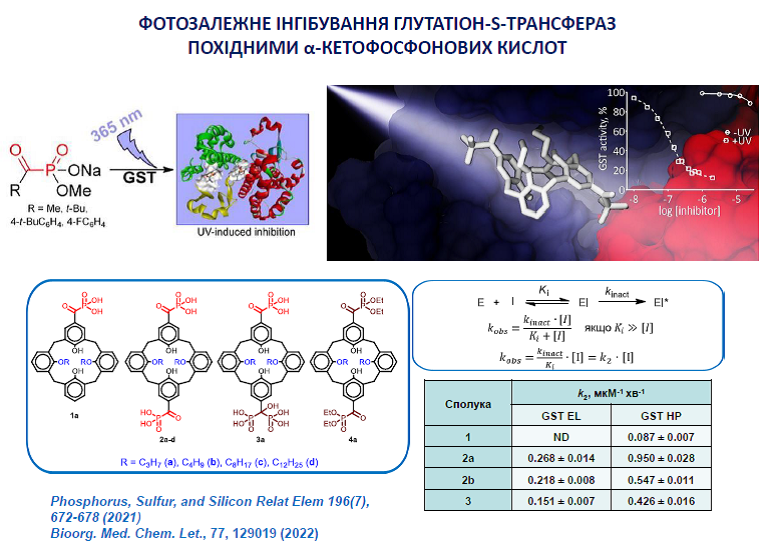
14. Kobzar O., Shulha Yu., Buldenko V., Cherenok S., Silenko O., Kalchenko V., Vovk A. Inhibition of glutathione S-transferases by photoactive calix[4]arene α-ketophosphonic acids. Med. Chem. Lett. 2022, 77, 129019. https://doi.org/10.1016/j.bmcl.2022.129019.

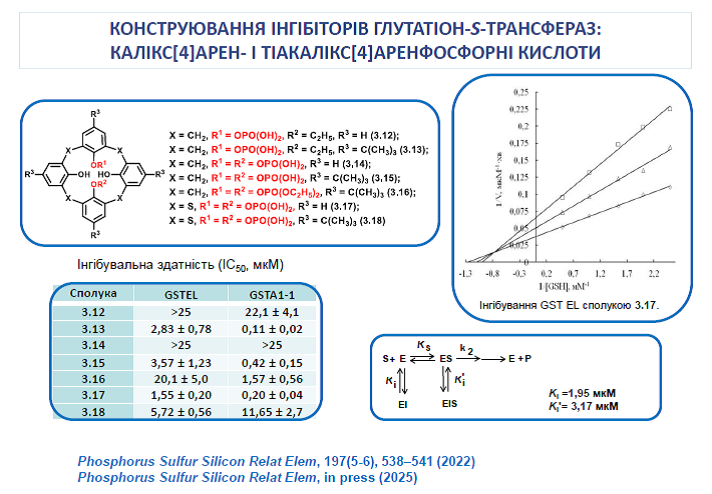
15. Silenko O., Cherenok S., Shulha, Kobzar O., Rusanov E., Karpichev E., Vovk A., Kalchenko V. Thiacalix[4]arene phosphoric acids. Synthesis, structure, and inhibition of glutathione S-transferases. Phosphorus, Sulfur, Silicon Relat. Elem. 2022, 197(5-6), 538-541. https://doi.org/10.1080/10426507.2021.2011877

16. Kobzar O. L., Shulha Yu. V., Buldenko V. M., Drapailo A. B., Kalchenko V. I., Vovk A. I. Inhibition of glutathione S-transferases by calix[4]arene-based phosphinic acids. Bioorg. Acta 2022, 17, 86-91. https://doi.org/10.15407/bioorganica2022.01.086
17. Kobzar, O. L., Cherenok, S. O., Kosterin, S., Kalchenko, V., Vovk, A. Biologically active calixarene phosphonic acids. Bioorg. Acta 2022, 17(2), 3-13. https://doi.org/10.15407/bioorganica2022.02.003
18. Velihina Y., Pilʹo S., Kobzar O., Zaliavska O., Prichard M. N., James S. H. Keith , Hartline C., Zhirnov V., Vovk A., Brovarets V. Synthesis of some oxazolo [4,5-d] pyrimidine derivatives and evaluation of their antiviral activity and cytotoxicity. Arkivok. 2022, 108-117. https://doi.org/10.24820/ark.5550190.p011.693
19. Kobzar, О. L., Shulha, Y. V., Buldenko, V. M., Mrug, G. P., Kolotylo, M. V., Stanko, O. V., Onysko P.P., Vovk, А. I. Alkyl and aryl α-ketophosphonate derivatives as photoactive compounds targeting glutathione S-transferases. Phosphorus, Sulfur, Silicon Relat. Elem. 2021, 196(7), 672-678. https://doi.org/10.1080/10426507.2021.1901703

20. Shatursky, O.Y., Manoilov, K.Y., Gorbatiuk, O.B., Usenko, M.O., Zhukova, D.A., Vovk, A.I., Kobzar, O.L., Trikash, I.O., Borisova. T.A., Kolibo, D.V., Komisarenko, S.V. The geometry of diphtheria toxoid CRM197 channel assessed by thiazolium salts and nonelectrolytes. Biophys J. 2021, 120(12), 2577-2591. https://doi.org/10.1016/j.bpj.2021.04.028.
21. А.І. Вовк, О.Л. Кобзар, Ю.М. Пархоменко. О-ацилзаміщені похідні і структурні аналоги вітаміну В1 . В кн. Синтез і біоактивність функціоналізованих азотовмісних гетероциклів / За редакцією А.І. Вовка. – Київ: ТОВ «НВП «Інтерсервіс», 2021. С. 151-180.
22. Sukhoveev, O. V., Burlaka, Y. B., Grin, N. V., Vovk, A. I., & Verevka, S. V. Studies of alterations of the cellular membrane barrier function at laryngeal cancer. Medical and Clinical Chemistry, 2021, 23(1), 5-12. https://doi.org/11603/mcch.2410-681X.2021.i1.12101
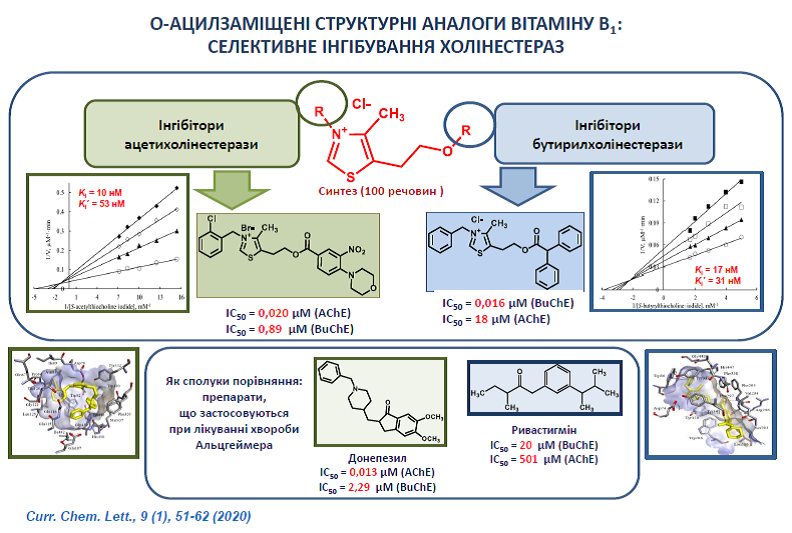
23. Kobzar O., Ocheretniuk A., Buldenko V., Babiy L., Kozachenko O., Brovarets V., Vovk A. O-Substituted N(3)-benzyl analogs of vitamin B1 as inhibitors of acetylcholinesterase or butyrylcholinesterase. Chem. Lett. 2020, 9(1), 51-62. http://doi.org/10.5267/j.ccl.2019.7.002
24. Muzychka, O. V., Kobzar, O. L., Shablykin, O. V., Brovarets, V. S., & Vovk, A. I. (2020). 5-Substituted N-(9H-purin-6-yl)-1, 2-oxazole-3-carboxamides as xanthine oxidase inhibitors. Bioorg. Acta 2020, 15(1), 20-25. https://doi.org/10.15407/bioorganica2020.01.020
25. Кобзар, О. Л., Година, Д. М., Синенко, В. О., Ковалішин, В. В., Трохименко, О. П., Сливчук, С. Р., Музичка, О. В. Прогнозування біоактивності і синтез нових 3-заміщених 5-тіазолілметиленроданінів. Доповіді НАН України. 2020, 5, 70-77. https://doi.org/10.15407/dopovidi05.070
26. Кобзар, О. Л., Татарчук, А. В., Качаєва, М. В., Пільо, С. Г., Суховєєв, О. В., Суховєєв, В. В., Вовк, А. І. Азометинові похідні п-амінобензойної кислоти як антиоксиданти та інгібітори ксантиноксидази. Доповіді НАН України. 2020, 6, 74-82. https://doi.org/10.15407/dopovidi2020.06.074
27. Kobzar O.L., Sinenko V.O., Shulha Y.V., Buldenko V.M., Hodyna D.M., Pilyo S.G., Brovarets V.S., Vovk A. I. Synthesis and evaluation of new thiazole-containing rhodanine-3-alkanoic acids as inhibitors of protein tyrosine phosphatases and glutathione S-transferases. Ukr. Bioorg. Acta 2020, 15(2), 33-40. https://doi.org/10.15407/bioorganica2020.02.033
28. Parkhomenko, Y., Vovk, A., & Protasova, Z. (2020). Vitamin B1 and the pyruvate dehydrogenase complex. In Molecular Nutrition (pp. 185-206) (Academic Press) https://doi.org/10.1016/B978-0-12-811907-5.00012-9
29. Poda G., Tanchuk V. "Computational Methods for the Discovery of Chemical Probes." In The Discovery and Utility of Chemical Probes in Target Discovery. 2020. 39-68. (Royal Society of Chemistry) https://doi.org/10.1039/9781839160745
30. Mezhenska O., Rebriev A., Kobzar O., Zlatoust N., Vovk A., Parkhomenko Yu. Non-coenzyme properties of thiamine: evaluation of binding affinity to malate dehydrogenase isoforms. Biotechnologia Acta 2020, 13(4), 26-38. https://doi.org/10.15407/biotech13.04.026
31. Shalimov, O., Rusanov, E., Muzychka, O., & Onys’ ko, P. (). Novel convenient approach to 6-, 7-, and 8-numbered nitrogen heterocycles incorporating endocyclic sulfonamide fragment. Molecules 2020, 25(12), 2887. https://doi.org/10.3390/molecules25122887
Публікації співробітників відділу за 2004-2019 рр.
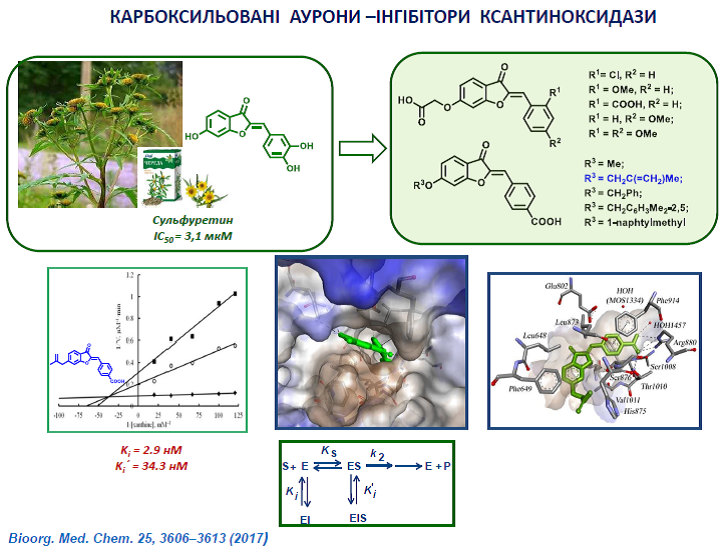
32. Muzychka O.V., Kobzar O.L., Popova A.V., Frasinyuk M.S., Vovk A.I. Carboxylated aurone derivatives as potent inhibitors of xanthine oxidase. Bioorg. Chem. 2017, 25, 3606–3613. https://doi.org/10.1016/j.bmc.2017.04.048

33. Khilya O., Milokhov D.S., Kononets L.A., Kobzar O.L., Vovk A.I., Volovenko Yu.M.. Synthesis and evaluation of new 2,6-diamino-5-hetarylpyrimidines as inhibitors of dihydrofolate reductase. Monatsh. Chem. 2018, 149, 813–822. DOI 10.1007/s00706-017-2032
34. Ocheretniuk A.D., Kobzar O.L., Mischenko I.M., Vovk I. N-Phenacylthiazolium alts as inhibitors of cholinesterases. French-Ukrainian J. Chem. 2017, 5, №2. https://doi.org/10.17721/fujcV5I2P1-14
35. Burlaka Y.B., Sukhoveev O.V., Grin N.V., Khilchevskyi O.M., Verevka S.V. EPR spectroscopy studies of changes in erythrocyte membranes in patients with laryngeal cancer. Experimental Oncology 2017, 39, 49–52. http://dspace.nbuv.gov.ua/handle/123456789/137612
36. Tanchuk V.Yu., Tanin V.O. Vovk A., Poda G. A New, Improved Hybrid Scoring Function for Molecular Docking and Scoring Based on AutoDock and AutoDock Vina. Chem. Biol. Drug Des. 2016, 87, 618-625. https://doi.org/10.1111/cbdd.12697
37. Melnyk, A. K., Sukhoveev, O. V., Kononets, L. A., Khilchevsky, O. M., Shulga, S. M., Kukhar, V. P., & Vovk, A. I. An EPR spin probe study of liposomes from sunflower and soybean phospholipids. Liposome Res. 2016, 26, 80-86. https://doi.org/10.3109/08982104.2015.1039031
38. Trush V.V., Kharchenko S.G., Tanchuk V.Yu., Kalchenko V.I., Vovk A.I. Phosphonate monoesters on a thiacalix[4]arene framework as potential inhibitors of protein tyrosine phosphatase 1B. Biomol. Chem. 2015, 13, 8803-8806. https://doi.org/10.1039/C5OB01247C
39. Trush V.V., Tanchuk V.Y., Cherenok S. O., Kalchenko V.I., Vovk A.. Evaluation of inhibition of protein tyrosine phosphatase 1B by calixarene-based α-ketophosphonic acids. Chem. Biol. Lett. 2015, 2, 1-5. https://pubs.iscience.in/journal/index.php/cbl/article/view/253
40. Kobzar O.L., Shevchuk M.V., Lyashenko A.N., Tanchuk V.Yu., Romanenko V.D., Kobelev S.M.,Averin A.D., Beletskaya I.P., Vovk A.I., Kukhar V.P. Phosphonate derivatives of tetraazamacrocycles as new inhibitors of protein tyrosine phosphatases. Org. Biomol. Chem. 2015, 13, 7437-7444. https://doi.org/10.1039/c5ob00713e
41. Kobzar O.L., Trush V.V., Tanchuk V.Yu., Vovk A.I. Inhibitory potential of polyhydroxylated fullerenes against protein tyrosine phosphatase 1B. Biochem. J. 2015, 87, 24-31. https://doi.org/10.15407/ubj87.04.024
42. Tanchuk V., Tanin V., Vovk A., Poda G. A new scoring function for molecular docking based on AutoDock and AutoDock Vina. Drug Discov. Technol. 2015, 12, 170-178. https://doi.org/10.2174/1570163812666150825110208
43. Mkrtchyan G., Aleshin V., Parkhomenko Y., Kaehne T., Di Salvo M. L., Parroni A., Contestabile R., Vovk A., Bettendorff L., Bunik V. Molecular mechanisms of the noncoenzyme action of thiamin in brain: biochemical, structural and pathway analysis Scientific Reports 2015, 5, Article number: 12583. https://doi.org/10.1038/srep12583
44. Kobzar O.L., Trush V.V., Tanchuk V.Yu., Zhilenkov A.V., Troshin P.A., Vovk A.I. Fullerene derivatives as a new class of inhibitors of protein tyrosine phosphatases. Med. Chem. Lett. 2014, 24, 3175–3179. https://doi.org/10.1016/j.bmcl.2014.04.110

45. Trush V.V., Tanchuk V.Y., Cherenok S.O., Kalchenko V.I., Vovk A.I. Calix[4]arene α-hydroxymethylphosphonic acids as potential inhibitors of protein tyrosine phosphatases. Org. Pharm. Chem. 2014, 1, 39-42. https://doi.org/10.24959/ophcj.14.782
46.Yu., Vovk A., Kalchenko V.I. Сalixarene methylene bisphosphonic acids as effectors of biochemical processes. In Book: “Ligands: synthesis, characterization and role im biotechnology”. Nova Science Publishers Inc. N.-Y., 2013. pp. 67-116.
47. Tanchuk V.Yu., Tanin V.O., Vovk A.I.. Analysis of сonformational flexibility of loop 110-120 of protein tyrosine phosphatase 1B. Biochim. J., 2013, 85, 73-80. http://dx.doi.org/10.15407/ubj85.05.073
48. Kalchenko V. I., Cherenok S.O., Kosterin S.O., Lugovskoy E.V., Komisarenko S.V., Vovk A.I., Tanchuk V.Y., Kononets L.A., Kukhar V.P. Calixarene phosphonous acids: synthesis and biological activity. Phosphorus, Sulfur, and Silicon 2013, 188, 232-237. https://doi.org/10.1080/10426507.2012.743147

49. Tanchuk V.Yu., Tanin V.O., Vovk A.I. QSAR models for predicting protein tyrosine phosphatase 1B inhibition by structurally diverse inhibitors. Org. Pharm. Chem. 2013, 11, 51-56.
50. Trush V.V., Cherenok S.O., Tanchuk V.Yu., Kukhar V.P., Kalchenko V.I., Vovk A.I. Calix[4]arene methylenebisphosphonic acids as inhibitors of protein tyrosine phosphatase 1B Med. Chem. Lett. 2013, 23, 5619–5623. https://doi.org/10.1016/j.bmcl.2013.08.040

51. Khakina E.A., Yurkova A.A., Peregudov A.A., Troyanov S.I., Trush V.V., Vovk A.I., Mumyatov A.V., Martynenko V.M., Balzarini J., Troshin P.A. Highly selective reactions of C60Cl6 with thiols for synthesis of functionalized [60]fullerene derivatives. Commun. 2012, 48, 7158-7160. https://doi.org/10.1039/C2CC32517A
52. Tanchuk V.Y., Tanin V.O., Vovk A.I. Classification of binding site conformations of protein tyrosine phosphatase 1B. Chem Biol Drug Des. 2012, 80, 121-128. https://doi.org/10.1111/j.1747-0285.2012.01370.x

53. Cherenok S.O., Yushchenko O.A., Tanchuk V.Yu., Mischenko I.M., Samus N.V., Ruban O.V., Matvieiev Y.I., Karpenko J.A., Kukhar V.P., Vovk A.I., Kalchenko V.I. Calix[4]arene-α-hydroxyphosphonic acids. Synthesis, stereochemistry, and inhibition of glutathione S-transferase. ARKIVOC 2012, 278 – 298. http://dx.doi.org/10.3998/ark.5550190.0013.421
54. Vovk A.I., Mischenko I.M., Cherenok S.O., Tanchuk V.Yu., Kalchenko V.I., Kukhar V.P. Phosphorylated calix[4]arenes as inhibitors of glutathione S-transferase. Phosphorus, Sulfur, and Silicon 2011, 186, 961-963. https://doi.org/10.1080/10426507.2010.514313
55. Vovk A.I., Tanchuk V.Yu., Kononets L.A., Cherenok S.O., Drapailo A.B., Kalchenko V.I., Kukhar V.P. A novel approach to the design of phosphonate inhibitors of protein tyrosine phosphatase. Phosphorus, Sulfur, and Silicon 2011, 186, 958-960. https://doi.org/10.1080/10426507.2010.521213
56. Kachkovskyi G.O., Kononets L.A., Tanchuk V.Yu., Vovk A.I., Kolodiazhnyi O.I. Synthesis and Evaluation of 1-Aryl-1-(7-carboxyisoindolin-1-one-2-yl)methyl-phosphonic Acid Derivatives as Inhibitors of Protein Tyrosine Phosphatase. Phosphorus, Sulfur, and Silicon 2011, 186, 956-957. https://doi.org/10.1080/10426507.2010.508063
57. Shapoval G.S., Babii L.V., Kruglyak O.S., VovkI. Antioxidant activity of thiamine and its structural analogs in reactions with electrochemically generated hydroxyl radicals and hydrogen peroxide. Theor. Exp. Chem. 2011, 47, 55-60. https://doi.org/10.1007/s11237-011-9185-y
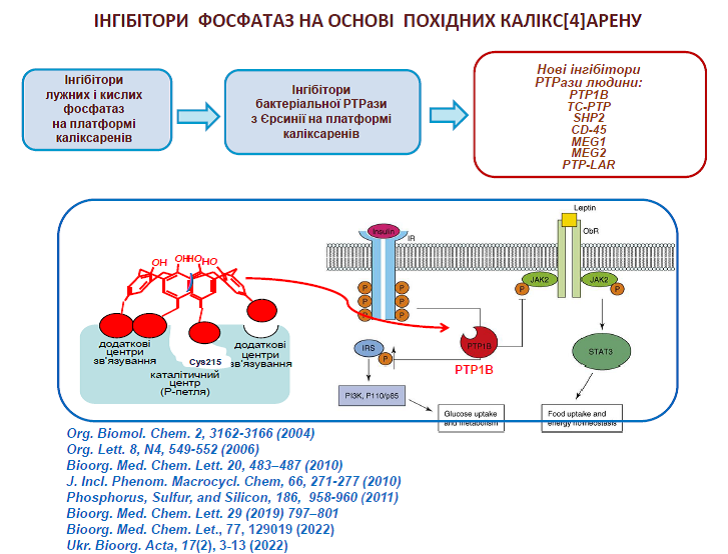
58. Vovk A.I., Kononets L.A., Tanchuk V.Yu., Cherenok S.O., Drapailo A.B., Kalchenko V.I., Kukhar V.P. Inhibition of Yersinia protein tyrosine phosphatase by phosphonate derivatives of calixarenes. Med. Chem. Lett. 2010, 20, 483-487. https://doi.org/10.1016/j.bmcl.2009.11.126

59. Vovk A.I., Kononets L.A., Tanchuk V.Yu., Drapailo A.B., Kalchenko V.I., Kukhar V.P. Thiacalix[4]arene as molecular platform for design of alkaline phosphatase J. Incl. Phenom. Macrocycl. Chem. 2010, 66, 271-277. https://doi.org/10.1007/s10847-009-9607-9

60. Vovk A., Shivanyuk A.M., Bugas, R.V., Muzychka, O.V., Melnyk, A.K. Antioxidant and antiradical activities of resorcinarene tetranitroxides. Bioorg. Med. Chem. Lett. 2009, 19, 1314-1317. https://doi.org/10.1016/j.bmcl.2009.01.070

61. Vovk A.I., Mischenko I.M., Tanchuk V.Yu., Kachkovskii G.A., Sheiko S.Yu., Kolodyazhnyi O.I., Kukhar V.P. Stereoselectivity of binding of (N-benzylamino)benzylphosphonic acids to prostatic acid phosphatase. Med. Chem. Lett. 2008, 18, 4620–4623. https://doi.org/10.1016/j.bmcl.2008.07.021

62. Vovk A., Kalchenko V., Tanchuk V., Muzychka O., Muravyova I., Shivanyuk A., Cherenok S., Kukhar V. Сalixarene methylenebisphosphonic acids: alkaline phosphatase inhibition and docking studies. Phosphorus, Sulfur, and Silicon 2008, 183, 625-626. https://doi.org/10.1080/10426500701793311
63. Garazd M.M., Muzychka O.V., Vovk A.I., Nagorichna I.V., Ogorodniichuk A.S. Modified coumarins. 27. Synthesis and antioxidant activity of 3-substituted 5,7-dihydroxy-4-methylcoumarins. Nat. Comp. 2007, 43, 19-23.
https://doi.org/10.1007/s10600-007-0055-8
64. Cherenok S., Vovk A., Muravyova I., Shivanyuk A., Kukhar V., Lipkowski J., Kalchenko V. Calix[4]arene α-aminophosphonic acids: asymmetric synthesis and enantioselective inhibition of an alkaline phosphatase. Org. Lett. 2006, 8, 549-552. https://doi.org/10.1021/ol052469a

65. Vovk A.I., Kalchenko V.I., Cherenok S.A., Kukhar V.P., Muzychka O.V., Lozynsky M.O. Calix[4]arene methylenebisphosphonic acids as calf intestine alkaline phosphatase inhibitors. Org. Biomol. Chem. 2004, 2, 3162-3166. https://doi.org/10.1039/B409526J
Гранти та конкурсні проєкти за період 2019-2024 рр.
Проєкт «Дизайн, синтез і активність похідних каліксаренів як інгібіторів протеїнтирозинфосфатаз та інших ензимів» за конкурсом НФДУ “Підтримка досліджень провідних та молодих учених”. Організація виконавець – Інститут органічної хімії НАН України. Організація-співвиконавець – Інститут біоорганічної хімії та нафтохімії ім. В.П. Кухаря НАН України (2020-2023 рр.).
Наукова робота «Створення сучасних каліксаренових регуляторів біохімічних процесів для медицини та біотехнології. Розділ 3. Пошук, конструювання і встановлення властивостей нових потенційно біоактивних похідних каліксаренів, спрямованих на терапевтично важливі протеїнові мішені» № держреєстрації 0124U001926 (Наукові і науково-технічні (експериментальні) роботи НАН України за пріоритетним напрямом «Розроблення сучасних методів та технологій (зокрема, молекулярно-генетичних та біотехнологій) для забезпечення біологічної і продовольчої безпеки держави, створення нових лікарських препаратів, методів і засобів діагностики для потреб медицини та ветеринарії» на 2023-2024 рр.).
Грант Національної академії наук для підтримки науково-дослідних робіт молодих учених НАН України «Прогнозування біоактивності, синтез і вивчення нових тіазоловмісних сполук як потенційних протиракових агентів» (2019-2020 рр.).
Грант НАН України дослідницьким лабораторіям/групам молодих вчених НАН України для проведення досліджень за пріоритетними напрямами розвиту науки і техніки «Пошук нових фотоконтрольованих інгібіторів терапевтично важливих ферментів» (шифр: GR-KO-2020) (2020-2021 рр.).
Проєкт науково-дослідних робіт молодих учених НАН України «Нові гідразоновмісні похідні азотистих гетероциклів як потенційні інгібітори пуринового метаболізму», номер держ. реєстрації 0121U111935 (2021-2022).
Захист дисертацій співробітниками відділу (з 2002 р.)
Бабій Л.В. Дисертація на здобуття наукового ступеня кандидата хімічних наук «Модельні окиснювальні перетворення тіаміну і тіамінфосфатів» – 2002 р.
Музичка О.В. Дисертація на здобуття наукового ступеня кандидата хімічних наук «Кінетичні закономірності інгібування лужної фосфатази з кишок теляти L-цистеїном відновленим глутатіоном і фосфоновими кислотами» – 2004 р.
Бугас Р.В. Дисертація на здобуття наукового ступеня кандидата хімічних наук «Моделювання перетворень вітаміну В1 і його структурних тіазолієвих аналогів в процесах біологічного транспорту» – 2004 р.
Кононець Л. А. Дисертація на здобуття наукового ступеня кандидата біологічних наук «Сірковмісні похідні фосфонових кислот як інгібітори фосфатаз» – 2012 р.
Труш В.В. Дисертація на здобуття наукового ступеня кандидата хімічних наук «Інгібування протеїнтирозинфосфатази 1В фосфонатними похідними калікс[4]аренів» – 2015 р.
Кобзар О.Л. Дисертація на здобуття наукового ступеня кандидата хімічних наук «Потенційні інгібітори протеїнтирозинфосфатаз на основі тетраазамакроциклів і фулеренів» – 2015 р.
Танін В.О. Дисертація на здобуття наукового ступеня кандидата хімічних наук – «Нові підходи до in silico дослідження інгібіторів протеїнтирозинфосфатази 1B» – 2016 р.
Булденко В.М. Дисертація на здобуття наукового ступеня кандидата хімічних наук (доктора філософії) «Сульфонілкалікс[4]арен як платформа для конструювання інгібіторів фосфатаз». – 2019 р.
Очеретнюк А.Д. Дисертація на здобуття наукового ступеня кандидата хімічних наук (доктора філософії) «Солі тіазолію як інгібітори ацетилхолінестерази».– 2019 р.
Шульга Ю.В. Дисертація на здобуття на здобуття наукового ступеня доктора філософії «Фосфонові, фосфінові і фосфорні кислоти як інгібітори глутатіон-S-трансфераз». – 2023 р.
Бейко А. В. Дисертація на здобуття на здобуття наукового ступеня доктора філософії «Інгібітори ксантиноксидази на основі карбоксильованих флавоноїдів та похідних азолів».– 2024 р.

Старший науковий співробітник, кандидат хімічних наук Олександр Кобзар

Молодший науковий співробітник, доктор філософії Юрій Шульга

Науковий співробітник, кандидат хімічних наук Олександр Суховєєв

Молодша наукова співробітниця, докторка філософії Альона Бейко

У кав’ярні. Ліворуч – В. Булденко, О. Кобзар, А. Вовк. Праворуч – А. Очеретнюк, О. Музичка, І.Міщенко, Л. Кононець

О.Кобзар (на передньому плані), А. Очеретнюк і В.Булденко (2018 р.)

Аспірант В. Булденко за роботою (2018 р.)

Аспірантка А.Очеретнюк (2019 р.)

В. Танчук (праворуч) і В. Танін (2016 р.)

Ю.В. Шульга – аспірант відділу (2019 р.)

Співробітники відділу (2016 р.) – В. Труш, О. Кобзар, О. Суховєєв, Л. Кононець, А. Вовк, О. Музичка, В. Танчук, І. Міщенко, А. Очеретнюк, В. Булденко

Співробітники відділу в лабораторії (2010 р.) – А. Вовк, Л. Бабій, Н. Самусь, І. Міщенко, О. Музичка, Л. Кононець, Р. Бугас
© 2026 IBOPC NAS of Ukraine