Історія лабораторії починається з початку діяльності відділу синтезу фізіологічно активних сполук фосфору, який був створений в 1991 р. на базі однойменної лабораторії, що входила до складу відділу тонкого органічного синтезу, яким керував академік НАН України Кухар Валерій Павлович. З моменту cтворення відділу синтезу фізіологічно активних сполук фосфору ним керував доктор хімічних наук, професор Колодяжний Олег Іванович (з 2012 р. член-кореспондент НАН України). В 2024 р. відділ було реорганізовано у лабораторію № 1.1 синтезу фізіологічно активних сполук фосфору у складі відділу № 1 тонкого органічного синтезу, яку очолила докторка хімічних наук Колодяжна Анастасія Олегівна.
Основні наукові напрями лабораторії:
Хімія ілідів фосфору. Асиметричний синтез органічних, елементорганічних та фосфорорганічних сполук та багаторазова асиметрична індукція. Синтез фосфорних аналогів природних сполук, потенційних біологічно активних сполук. Біокаталітичний синтез оптично активних сполук, сполук аналогів природніх речовин, речовин із потенційною біологічною та активністю.
Дослідження лабораторії спрямовані на розробку препаративних методів синтезу органічних, елементорганічних та фосфорорганічних сполук із потенційною біологічною активністю, а також на встановлення основних закономірностей їх хімічної поведінки та виявлення можливостей використання цих хіральних синтонів у синтезі енантіомерно чистих біорегуляторів.
Основні наукові та практичні досягнення співробітників лабораторії
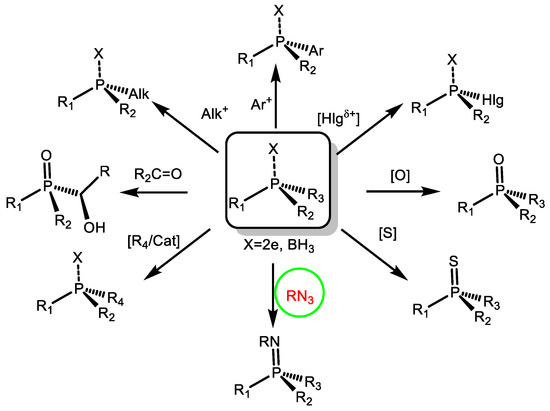
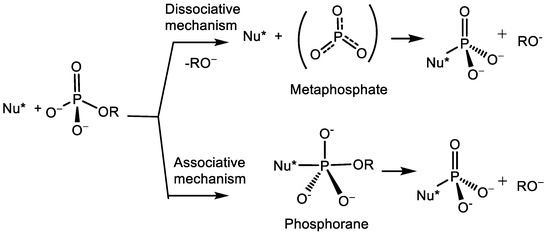
1. Вперше узагальнено стереохімію нуклеофільного замішеня біля атома фосфору. На основі виконаних теоретичних досліджень розроблено препаративний метод синтезу оптично активних третинних фосфінів, які є важливими реагентами органічного синтезу, використовуються як хіральні ліганди у асиметричному металлокомплексному каталізі. Встановлено механізм реакції. Знайдено, що SN2(P) реакція хіральних спиртів, а також хіральних амінів з хлорфосфінами в присутності третинних основ протікає з трансфером хіральності від нуклеофілу на атом фосфору. Запропоновано механізм фосфорилювання-дефосфорилювання аденозин трифосфату, який є найважливішою енергогенною молекулою, що забезпечує життєдіяльність живих організмів, Реакция протікає по мономолекулярному механізму через утворення метафосфат-аніону. Вивчено стереохімію реакції SN1(P).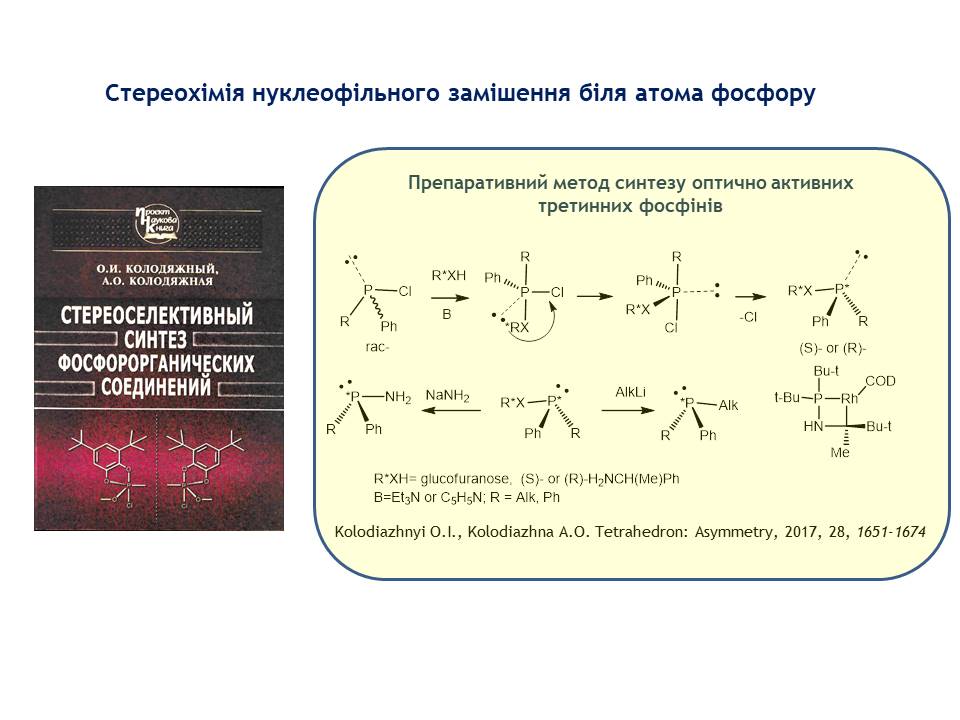
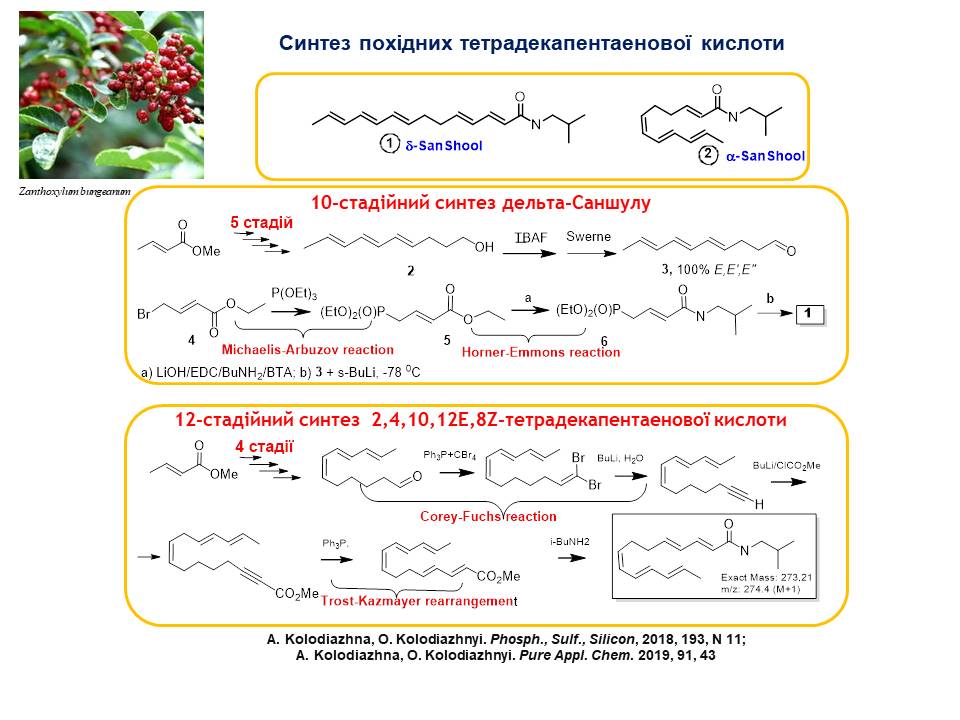
2. Розроблено стереоселективні багатостадійні методи синтезу альфа та гамма-похідних тетрадекапентаєнової кислоти, виділених із тропічних рослин Zanthoxylum bungeanum (Rutaceae) які володіють цікавими фармакологічними властивостями (інгібітори проліферації клітин та активатори апоптозу). 10-Стадійний метод синтезу похідних транс-тетрадекапентаєнової кислоти розроблений з використанням реакції Корі-Фукса та реакції Хорнера-Еммонса на ключових етапах. В дванадцятистадійному методі синтезу, похідних (2,4,10,12E, 8Z)-тетрадекапентаєнової кислоти використовували Z-селективну реакцію Віттіга, реакцію Корі-Фукса, а також перегрупування Троста-Казмайера. Синтезовані речовини повністю відповідають природним сполукам, одержаних з природних джерел.
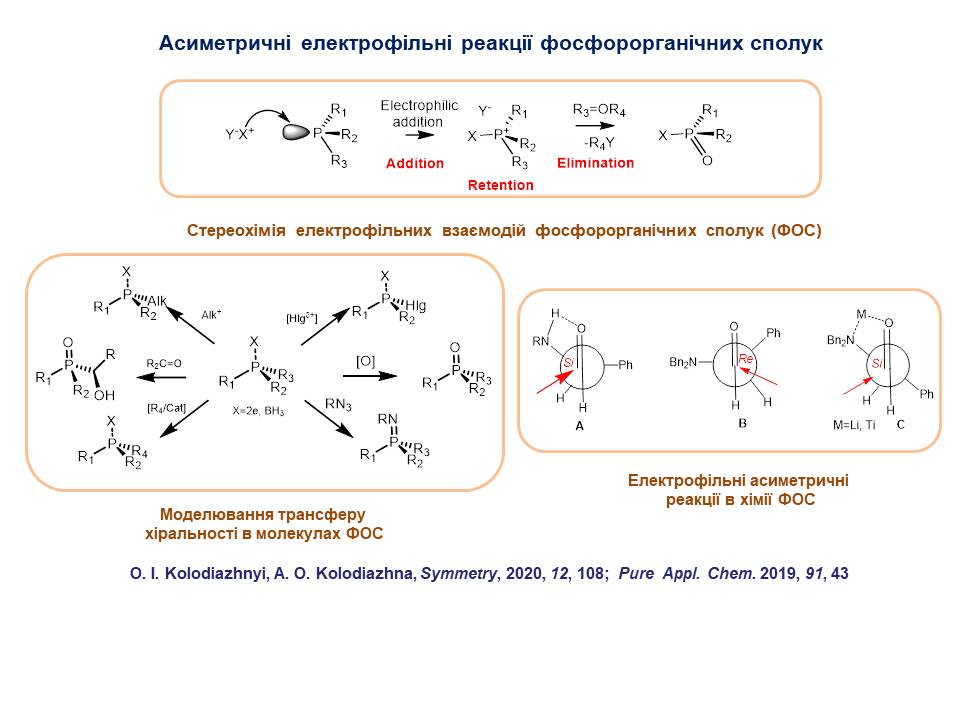
3. Вивчено електрофільні реакції оптично активних фосфорорганічних речовин. Запропоновано загальний механізм електрофільних взаємодій у атома фосфору. Показано, що реакції електрофільного заміщення протікають стереоспецифічно зі збереженням абсолютної конфігурації у фосфорного реакційного центру і проходять по типу приєднання-елімінування. Вивчено механізм перенесення хіральності від асиметричних центрів на атом фосфору, і в зворотному напрямі від хірального атома фосфору на інші реакційні центри на прикладі реакцій Хірао, лігування по-Штаудінгеру, галогенофільних реакцій, та ін. Розроблено нові варіанти асиметричних електрофільних реакцій, які можна застосувати для синтезу енантіомерно чистих P-хіральних сполук.
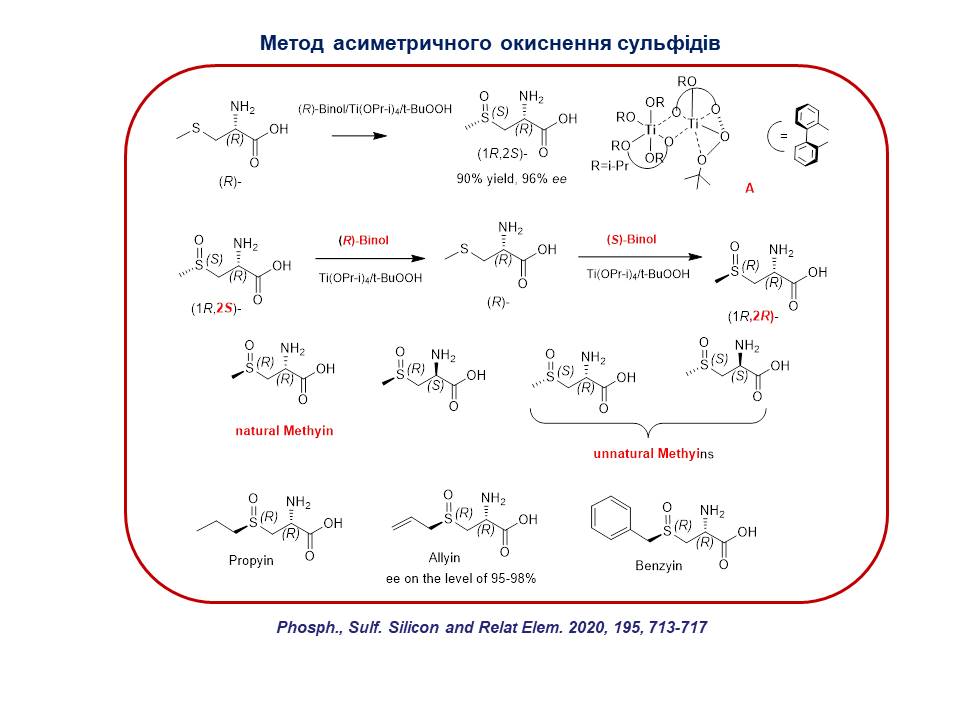
4. Розроблено загальний метод асиметричного електрофільного окиснення різноманітних несиметричних сульфідів за допомогою хірального комплексу тетраізопропоксид титану/трет-бутилгідропероксид/(S)- або (R)-бінол, що дозволяє одержувати (S)- або (R)-сульфоксиди з високим енантіомерним надлишком. Показано, що при використанні комплексу, що містить (S)-бінол утворюється (R)-сульфоксид, і навпаки, вміст (R)-бінолу призводить до утворення (S)-сульфоксиду. Цей метод був застосований для окиснення сірковмісних похідних амінокислот, що дозволило одержати низку оптично активних природних сульфоксидів.
5. Проведено кінетичне дослідження реакції дерацемізації вторинних спиртів ліпазами. Встановлено, що кінетична крива реакції має S-подібний характер, типовий для реакцій автокаталізу. Виявлено три етапи реакції біокаталітичної естерифікації.
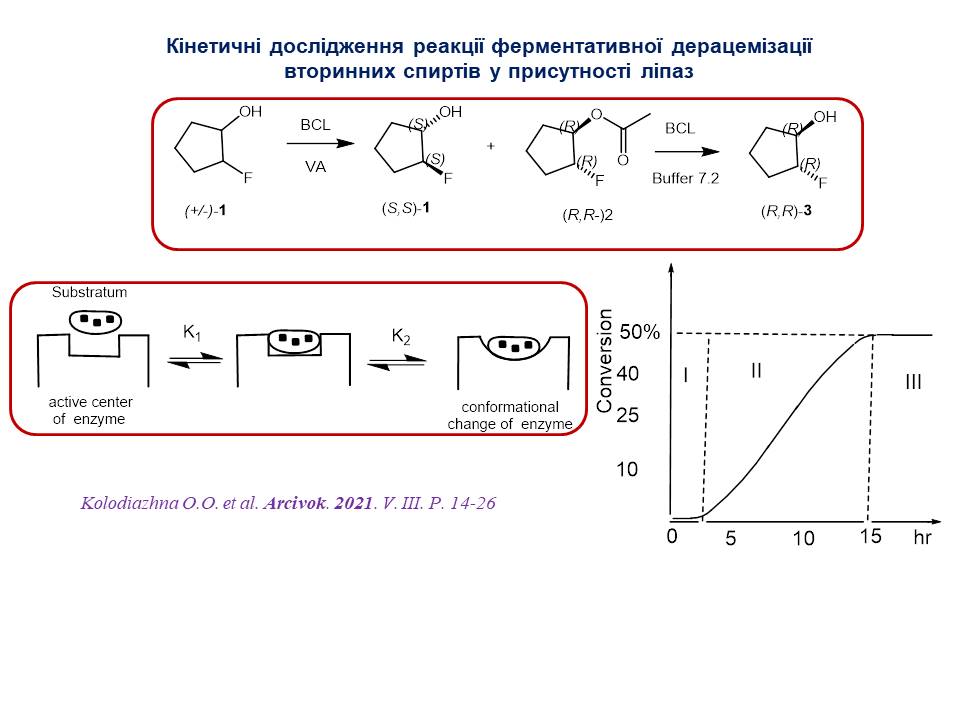
6. З використанням асиметричного органокаталізу та металокомплексного каталізу розроблено методи синтезу хіральних фосфоровмісних аналогів природних сполук. Запропоновано високоточний конвергентний метод визначення абсолютної конфігурації п’ятичленних циклоалканолів із комбінованим використанням хіральної ВЕРХ, ферментативного аналізу і правила Казлаускаса.
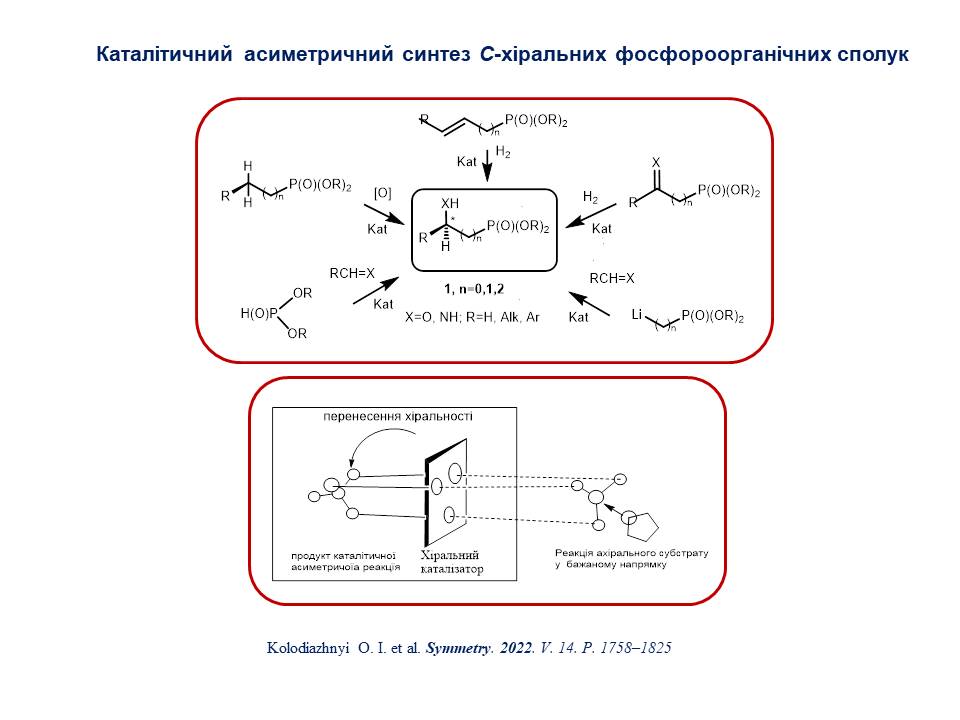
7. Запропоновано новий підхід до розробки сучасних фармпрепаратів, що враховує регулюючі норми Управління з контролю за продуктами та ліками США (FDA) з хіральних сполук при розробці та схваленні ліків. Суттю методу є перехід від рацемічних фармпрепаратів до енантіомерно чистих представників. Методи віртуального скринінгу та молекулярного моделювання дозволяють ідентифікувати провідні сполуки з використанням розрахованих енергій вільних зв'язків. Однак через синтетичні труднощі в отриманні енантіомерно чистих стереомерів і методів їх зв'язування важливо починати з визначення точної стереохімії сполук у віртуальних бібліотеках-кандидатів у ліки. та закінчуючи взаємодією з іншими біологічними мішенями, що може призвести до небажаних контрпродуктивних ефектів. Розроблений комплекс методів, що сприяють створенню ефективних ліків, отримав назву «Хіральні технології», серед яких найбільший інтерес представляють технології «Chiral switches» і «Chiral Prodrugs».
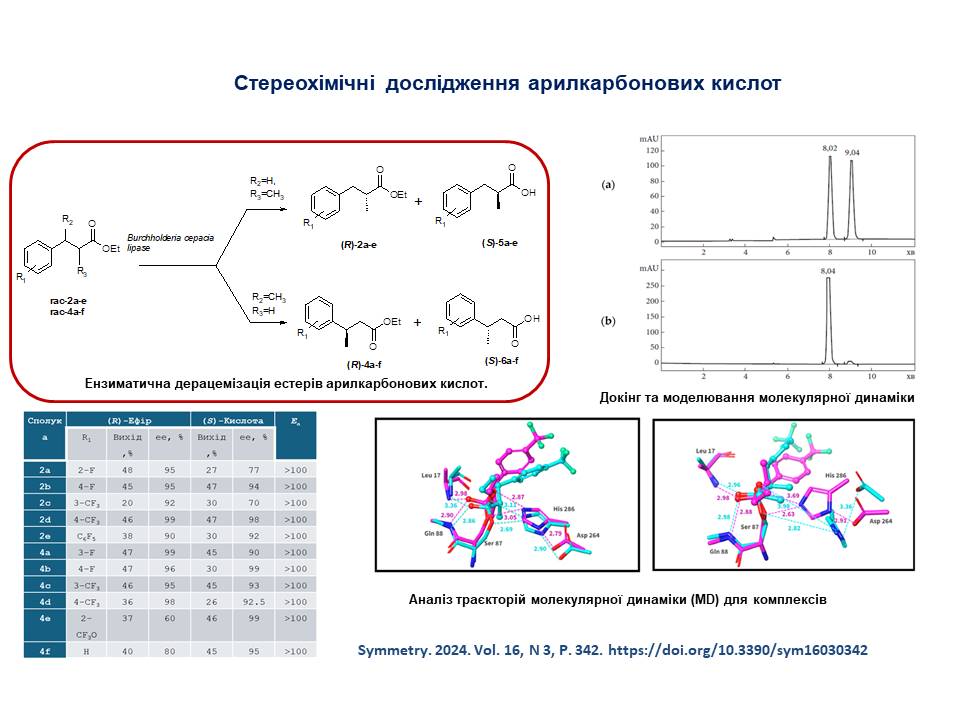
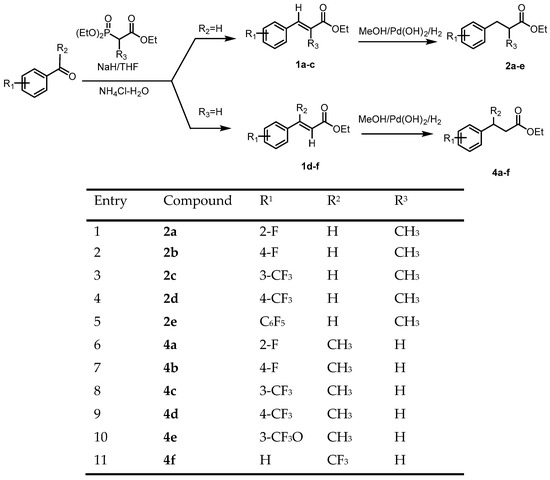
8. Розроблено методи синтезу енантіомерно чистих 3-арил-2-метилпропаноатів та 3-арилбутаноатів з використанням методології ензиматичної дерацемізації.
Співробітники лабораторії

Гришкун Євген Володимирович. Інженер І категорії, к.х.н
https://www.scopus.com/authid/detail.uri?authorId=6603458102&origin=resultslist

Шейко Сергій Юрійович, науковий співробітник, к.х.н.

Присяжнюк Дмитро Вячеславович, молодший науковий співробітник, доктор філософії
https://orcid.org/0000-0003-3286-4316

Колодяжна Ольга Олегівна, інженер І категорії, к.х.н.
https://orcid.org/0000-0002-2438-5895
https://www.scopus.com/authid/detail.uri?authorId=26537545400&origin=resultslist

Файзієв Олег Олегович, аспірант
Деякі найбільш важливі публікації:
1. Колодяжный О.И. Химия илидов фосфора Киев: “Наукова думка”, 1994. C.1-560. (монографія).
2. Kolodiazhnyi O.I. New achievements in asymmetric synthesis of organophosphorus compounds.advances of asymmetric synthesis (Eds Alfred Hassner). JAI Press Inc. Stamford-London 1998. Vol. 3, P. 273-323. (chapter in monograph).
3. Kolodiazhnyi O.I. Phosphorus Ylides. Chemistry and Application in Organic Synthesis J. Wiley-VCH. Weinheim-New York-Chichester. 1999, P.1-565. (monograph).
4. О. И. Колодяжный, А. О. Колодяжна. Стереоселективный синтез фосфорорганических соединений. «Наукова Думка», 2017, 342 с. (монографія)
5. Kolodiazhnyi O. I. Multiple stereoselectivity and its application in organic synthesis. Tetrahedron, 2003, Vol. 59, P. 5953-6018. (review) https://doi.org/10.1016/S0040-4020(03)00911-6

6. Kolodiazhnyi O. I. Asymmetric synthesis of hydroxyphosphonates. Tetrahedron: Asymmetry, 2005, Vol. 16, P. 3295-3340. (review). https://doi.org/10.1016/j.tetasy.2005.09.007

7. Guliaiko, Irina; Nesterov, Vitaly; Sheiko, Sergei; Kolodiazhnyi, Oleg I.; Freytag, Matthias; Jones, Peter G.; Schmutzler, Reinhard. Synthesis of optically active hydroxyphosphonates. Heteroatom Chemistry, 2008, vol. 19, # 2, p. 133 - 139. https://onlinelibrary.wiley.com/doi/10.1002/hc.20391
8. Kachkovskyi, Georgiy O.; Kolodiazhnyi, Oleg I. Synthesis of phosphonic acids possessing isoindolin-1-one moiety: Unexpected acid-catalyzed С-P-bond cleavage. Phosphorus, Sulfur and Silicon and the Related Elements, 2009, vol. 184, # 4, p. 890 – 907. https://doi.org/10.1080/10426500802715601
9. Kolodiazhnyi, Oleg I.; Gryshkun, Evgen V.; Kolodiazhna, Anastasya O.; Kachkovskyi, Georgy O.; Kolodiazhna, Olga O.; Sheiko, Sergyi Yu; Zemlianoi, Viacheslav N. New methods for the synthesis of phosphonic analogues of natural compounds. Phosphorus, Sulfur and Silicon and the Related Elements, 2011, vol. 186, # 4, p. 644 – 651. https://doi.org/10.1080/10426507.2010.511359
10. Gryshkun, Yevgen V.; Nesterov, Vitalyi M.; Kolodyazhnyi Oleh I. Enantioselective reduction of ketophosphonates using adducts of chiral natural acids with sodium borohydride. Arkivoc, 2012, vol. 2012, # 4, p. 100 – 117. https://doi.org/10.3998/ark.5550190.0013.409
11. Kolodiazhnyi, Oleg I. Recent developments in the asymmetric synthesis of -chiral phosphorus compounds. Tetrahedron: Asymmetry, 2012, vol. 23, # 1, p. 1 – 46. (review) https://doi.org/10.1016/j.tetasy.2012.01.007

12. Kolodiazhnyi, Oleg I. Advances in asymmetric hydrogenation and hydride reduction of organophosphorus compounds. Phosphorus, Sulfur and Silicon and the Related Elements, 2014, vol. 189, p. 1102 – 1131. (review) https://doi.org/10.1080/10426507.2014.905778

13. Kolodiazhnyi, Oleg I.; Kukhar, Valery P.; Kolodiazhna, Anastasy O. Asymmetric catalysis as a method for the synthesis of chiral organophosphorus compounds. Tetrahedron Asymmetry, 2014, vol. 25, # 12, p. 865 - 922. (review) https://doi.org/10.1016/j.tetasy.2014.05.010

14. Kolodiazhna, Anastasia O.; Kolodiazhnyi, Oleg I. Synthesis and properties of four-membered phosphorus heterocycles-2-Fluoro-1,2λ5-Oxaphosphetanes. Phosphorus, Sulfur and Silicon and the Related Elements, 2015, vol. 190, # 12, p. 2232 – 2245. https://doi.org/10.1080/10426507.2015.1054485

15. Kolodiazhnyi, Oleg I.; Kolodiazhna, Anastasy O.Multiple stereoselectivity in organophosphorus chemistry. Phosphorus, Sulfur and Silicon and the Related Elements, 2016, vol. 191, # 3, p. 444 – 458. (review) https://doi.org/10.1080/10426507.2015.1091831

16. Kolodiazhnyi, Oleg I.; Kolodiazhna, Anastasy. Nucleophilic substitution at phosphorus: stereochemistry and mechanisms. Tetrahedron Asymmetry, 2017, vol. 28, # 12, p. 1651 – 1674. https://doi.org/10.1016/j.tetasy.2017.10.022

17. Kolodiazhnyi, Oleg I.; Kolodiazhna, Anastasy O. Stereochemistry of nucleophilic substitution at trivalent phosphorus. Phosphorus, Sulfur and Silicon and the Related Elements, 2017, vol. 192, # 6, p. 621 – 633. https://doi.org/10.1080/10426507.2017.1284842

18. Kolodiazhnyi, Oleg I. Stereochemistry of electrophilic and nucleophilic substitution at phosphorus. Phosphorus, Sulfur and Silicon and the Related Elements, 2019, vol. 194, # 4-6, p. 396 – 400. https://doi.org/10.1080/10426507.2018.1521409

19. Kolodiazhnyi, Oleg I. Stereochemistry of electrophilic and nucleophilic substitutions at phosphorus. Pure and Applied Chemistry, 2019, vol. 91, # 1, p. 43 – 57. https://doi.org/10.1515/pac-2018-0807

20. Kolodiazhna, Anastasy; Kolodiazhnyi, Oleg. Stereoselective syntheses of sanshool derivatives. Phosphorus, Sulfur and Silicon and the Related Elements, 2019, vol. 194, # 4-6, p. 275 – 276. https://doi.org/10.1080/10426507.2018.1514404

21. Kolodiazhna, Anastasy O.; Kolodiazhnyi, Oleg I. Asymmetric electrophilic reactions in phosphorus chemistry. Symmetry, 2020, vol. 12, # 1, art. no. 108. https://doi.org/10.3390/sym12010108
22. Kolodiazhna, Olga O.; Prysiazhnuk, Dmitry V.; Kolodiazhna, Anastasy O.; Kolodiazhnyi, Oleg I. Synthesis of optically active vicinal fluorocyclopentanols and fluorocyclopentanamines by enzymatic deracemization. Arkivoc, 2021, vol. 2022, # 3. https://doi.org/10.24820/ark.5550190.p011.634
23. Kolodiazhnyi, Oleg I. Phosphorus compounds of natural origin: Prebiotic, stereochemistry, application. Symmetry, 2021, vol. 13, # 5, art. no. 889. https://doi.org/10.3390/sym13050889
24. Kolodiazhna, Anastasy O.; Kolodiazhnyi, Oleg I. Catalytic Asymmetric Synthesis of C-Chiral Phosphonates. Symmetry, 2022, vol. 14, # 9, art. no. 1758. https://doi.org/10.3390/sym14091758

25. Kolodiazhnyi, Оleg; Kolodiazhna, Anastasy; Grishkun, Evgen; Prysiazhnuk, Dmitry; Kolodiazhna, Olga; Sheiko, Sergei. Achievements in developments of organophosphorus stereochemistry. Phosphorus, Sulfur and Silicon and the Related Elements, 2022, vol. 197, # 5-6, p. 474 – 479.https://doi.org/10.1080/10426507.2021.2011874

26. Kolodiazhna, Anastasy O.; Kolodiazhnyi, Oleg I. Chiral Organophosphorus Pharmaceuticals: Properties and Application. Symmetry, 2023, vol. 15, # 8, art. no. 1550. https://doi.org/10.3390/sym15081550
27. Kolodiazhnyi, Oleg I.; Kolodiazhna, Anastasiia O.; Faiziiev, Oleh; Gurova, Yuliia. Enzymatic Deracemization of Fluorinated Arylcarboxylic Acids: Chiral Enzymatic Analysis and Absolute Stereochemistry Using Chiral HPLC. Symmetry, 2024, vol. 16, # 9, art. no. 1150. https://doi.org/10.3390/sym16091150
28. Kolodiazhna, Anastasy; Prysiazhnuk, Dmitry; Kolodiazhnyi, Oleg. Enzymatic resolution of heterocyclic intermediates for biologically active compound preparation. Phosphorus, Sulfur and Silicon and the Related Elements, 2024, vol. 199, # 10-12, p. 843 – 855. https://doi.org/10.1080/10426507.2024.2367033

29. Kolodiazhnyi, Oleg I.; Kolodiazhna, Anastasy O. Stereoselective Syntheses of Organophosphorus Compounds. Symmetry, 2024, vol. 16, # 3, art. no. 342. https://doi.org/10.3390/sym16030342

Співробітники лабораторії (березень 2025 р.). Зліва направо: Файзієв О.О., Колодяжна О.О., Присяжнюк Д.В., Колодяжна А.О., Шейко С.Ю., Гришкун Є.В.

Член-кореспондент НАН України Колодяжний О.І. зі своїми польськими колегами на XX міжнародному симпозіумі «Досягнення хімії гетероорганічних сполук», 2017 р. Лодзь, Польща.

Колодяжна А.О. на 18-му європейському симпозіумі з хімії фторорганічних сполук, 2016 р., Київ, Україна.

Захист докторської дисертації Колодяжної А.О. 2017 р.

Колодяжний О.І. та Колодяжна А.О., ХХV Українська конференція з органічної хімії, 2019 р., Луцьк
Доповідь аспіранта Присяжнюка Д.В. на ХХXVІІ науковій конференції з біоорганічної хімії та нафтохімії, 2022 р.
© 2026 IBOPC NAS of Ukraine